Antwort Welche Bindung ist H2? Weitere Antworten – Was sind Wasserstoff Bindungen
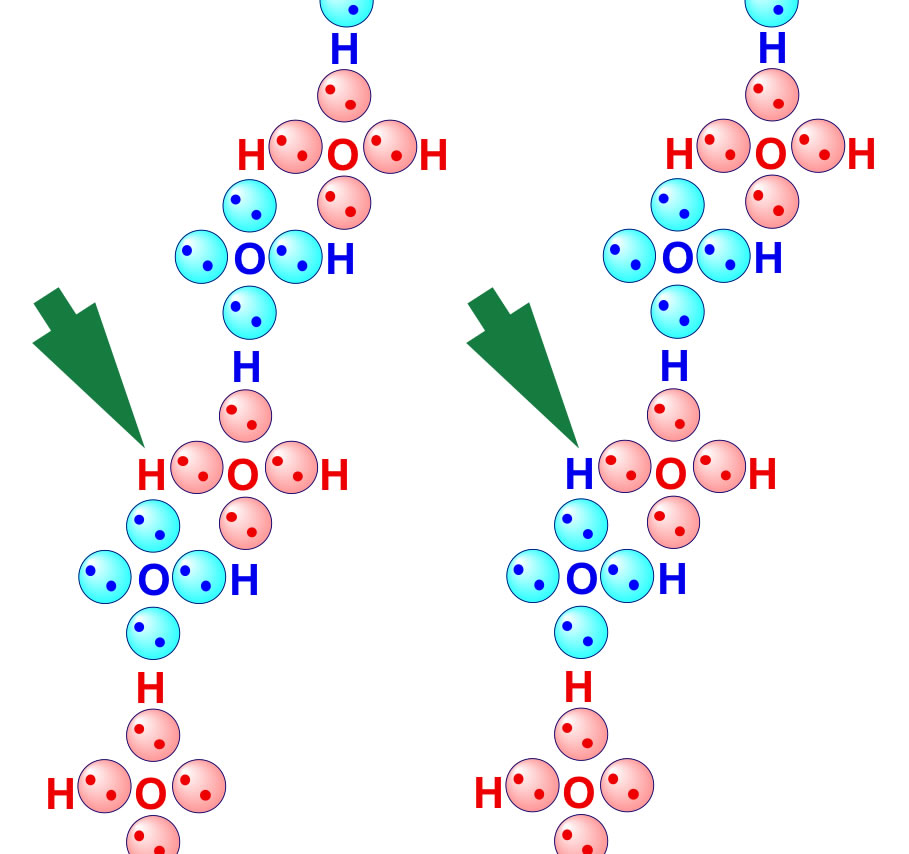
Bei Wasserstoffbrückenbindungen kommt es zu einer Anziehung zwischen einem Wasserstoffatom, welches an ein Molekül gebunden ist, und einem freien Elektronenpaar eines anderen Moleküls. Es handelt sich dabei um die stärksten zwischenmolekularen Wechselwirkungen.Wasserstoff ist ein chemisches Element, das in der Natur vorkommt, zum Beispiel in Kombination mit Sauerstoff-Atomen als Wasser (H2O), aber auch in Biomasse oder Kohlenwasserstoffen wie Erdöl oder Erdgas. Das chemische Element wird mit H2 abgekürzt.Wassermoleküle sind Dipole
Im Wassermolekül sind je zwei Wasserstoffatome über eine Elektronenpaarbindung an ein Sauerstoffatom gebunden. Die Elektronenpaarbindung besteht aus zwei Elektronen und wird mit einem Strich verdeutlicht.
Ist Wasserstoff polar oder unpolar : Beispiele: Wasserstoff (unpolar)
Wasserstoff bekommt bei dieser chemischen Reaktion die Edelgaskonfiguration von Helium.
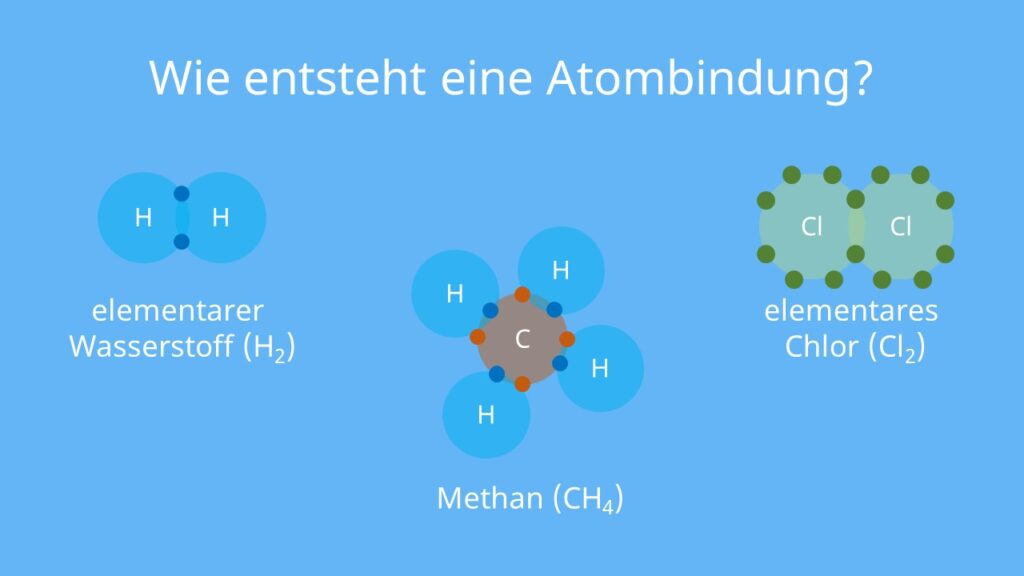
Ist Wasserstoff eine Atombindung
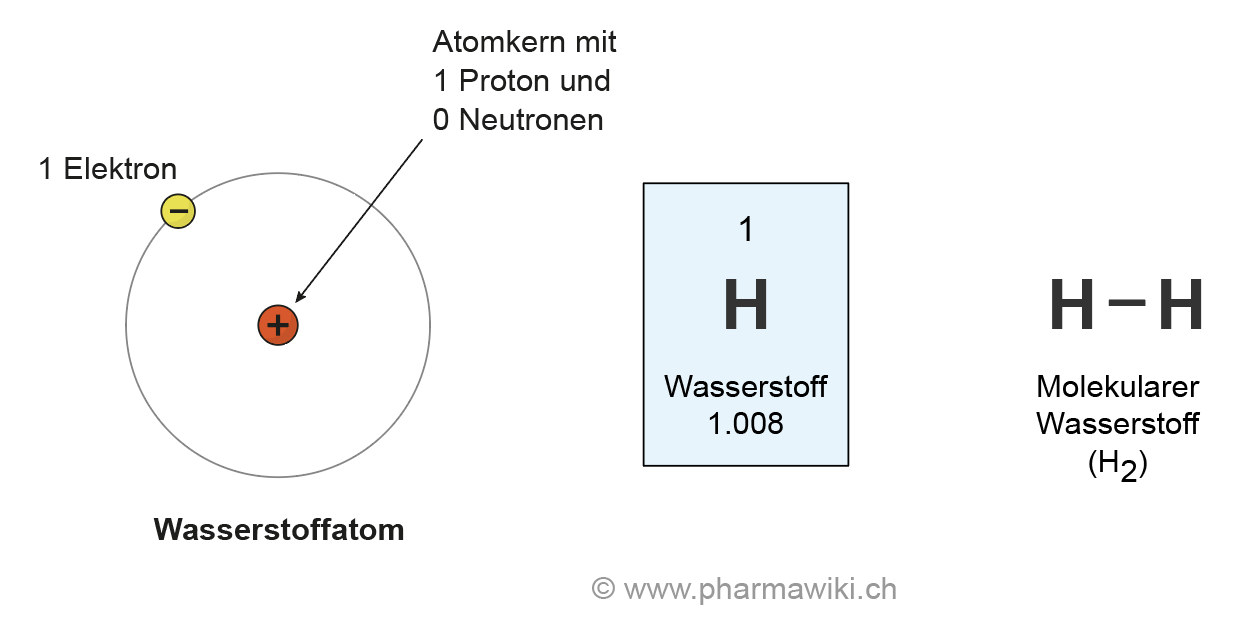
Für Wasserstoff ist die Regel daher mit nur zwei Elektronen erfüllt und liegt dementsprechend als Molekül vor, das durch eine Atombindung (H−H) zusammengehalten wird.
Sind Wasserstoffbrücken Van-der-Waals-Kräfte : Aufgrund ihrer Stärke unterscheidet man drei Typen zwischenmolekularer Kräfte: Wasserstoff-Brücken-Bindung – Dipol-Dipol-Wechselwirkung – Van-der-Waals-Kraft Eine Wasserstoffbrücke ist stärker als eine Dipol-Dipol-Wechselwirkung, welche wiederum die Stärke einer Van-der-Waals-Kraft übertrifft.
Eine Wasserstoffverbindung, die du wahrscheinlich kennst, ist das Wasser oder auch H20. In dieser Form kommt das Element Wasser in allen Tieren, Pflanzen und Menschen auf unserer Erde vor. Im Gegensatz zu Wasser ist Wasserstoff sogar brennbar.
Das Molekül Wasserstoff ist unpolar und somit kein Dipol.
Ist H2O eine Einfachbindung
Schauen wir uns dazu die H 2 O H_2O H2O-Strukturformel genauer an: In Wasser liegt zwischen Sauerstoff und den Wasserstoffatomen jeweils eine Einfachbindung vor. Eine Bindung setzt sich aus zwei Elektronen zusammen, wobei jeweils ein Elektron vom Sauerstoff- und vom Wasserstoffatom stammt.Atombindung am Beispiel vom Wassermolekül
Das Wassermolekül (H2O) ist ein typisches Beispiel für eine polare kovalente Bindung. Es besteht aus zwei Wasserstoffatomen (H), die jeweils mit einem Sauerstoffatom (O) eine Elektronenpaarbindung eingehen. Das Sauerstoffatom hat außerdem noch zwei freie Elektronenpaare.Atombindung am Beispiel vom Wassermolekül
Das Wassermolekül (H2O) ist ein typisches Beispiel für eine polare kovalente Bindung. Es besteht aus zwei Wasserstoffatomen (H), die jeweils mit einem Sauerstoffatom (O) eine Elektronenpaarbindung eingehen. Das Sauerstoffatom hat außerdem noch zwei freie Elektronenpaare.
Polarität Wasser
Wasser ist das typische Beispiel für ein polares Molekül. Es besteht aus zwei Wasserstoffatomen (H) und einem Sauerstoffatom (O). EN von 1,4. Wasser ist also stark polar.
Was gibt es für chemische Bindungen : Welche chemische Bindungen gibt es An chemischen Bindungen gibt es die Ionenbindungen, die Elektronenpaarbindungen, metallische Bindungen, Wasserstoffbrückenbindungen und die Van-der-Waals-Kräfte.
Welche Wasserstoffbrückenbindungen gibt es : Wie entstehen Wasserstoffbrückenbindungen
| Stärke der Bindung | Energie | Beispiel |
|---|---|---|
| starke Bindung | 63-167 kJ/mol | Fluorwasserstoff (HF) |
| mittlere Bindung | 17-63 kJ/mol | Kohlenhydrate, Wasser |
| schwache Bindung | <17 kJ/mol | Proteine |
12.12.2019
Wann hat man Van-der-Waals-Kräfte
Van-der-Waals-Kräfte entstehen nur, wenn keine permanenten Dipole vorliegen. Ein Dipol entsteht durch eine Ladungsverschiebung zwischen zwei Atomen, die miteinander eine Atombindung eingehen.
Das H2-Molekül
Wasserstoff kommt in Form von H2-Molekülen vor. Zwei H-Atome sind in diesen durch eine kovalente Bindung (Atombindung) miteinander verbunden.Auf der anderen Seite befinden sich die partiell positiv geladenen Wasserstoff-Atome. Das Molekül weist also zwei Pole auf, die unterschiedlich geladen sind und örtlich nicht zusammenfallen. Daher spricht man von einem Dipol-Molekül (= Zwei-Pol-Molekül).
Welche Bindungsart ist Wasser : Im Wassermolekül ist das Sauerstoffatom mit jeweils einem Wasserstoffatom über eine sogenannte Elektronenpaarbindung, auch kovalente Bindung genannt, verknüpft. Das bedeutet hier, dass sich das Sauerstoffatom (O) und jeweils ein Wasserstoffatom (H) zwei Elektronen 'teilen'.